کشفی که میتواند درمان پوکی استخوان را متحول کند
یک سوئیچ گیرنده تازه کشف شده که رشد استخوان را افزایش میدهد، میتواند با تحریک دستگاه استخوانسازی بدن با استفاده از یک داروی هدفمند و حتی نیروی مکانیکی، نحوه درمان پوکی استخوان را متحول کند.
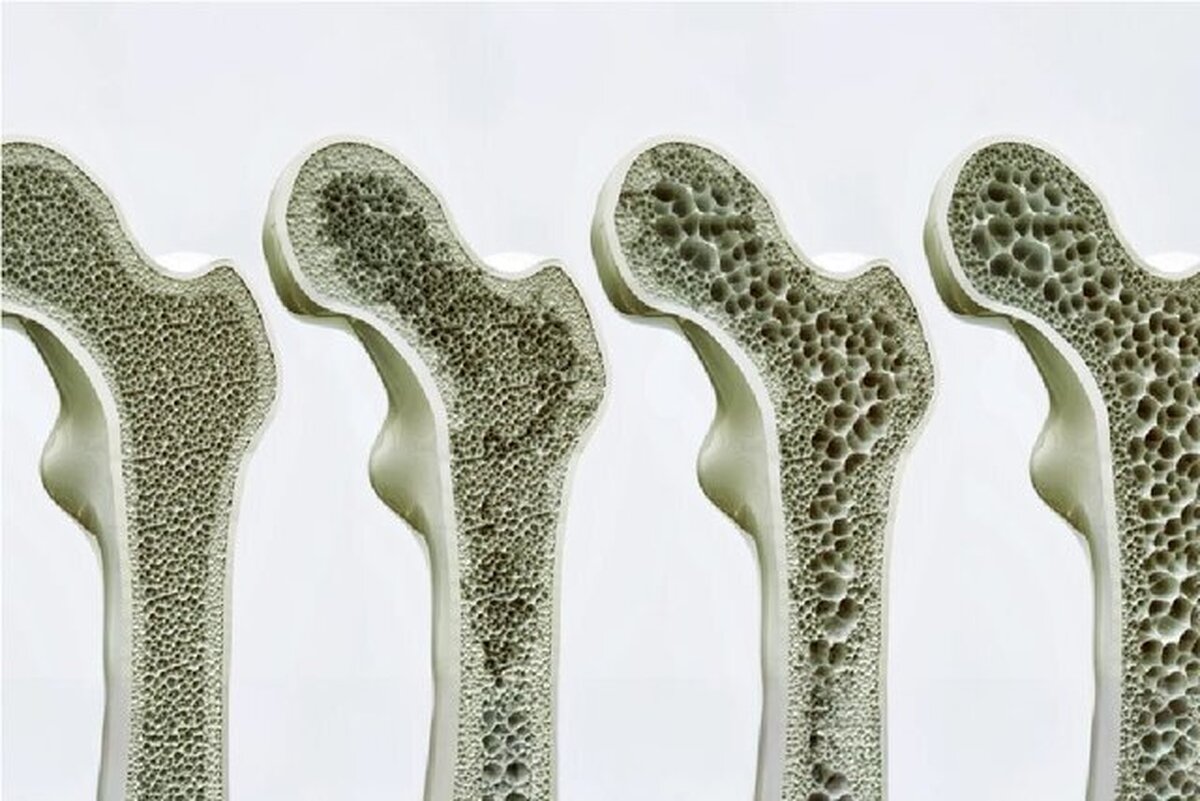
استئوبلاستها (Osteoblasts) سلولهای تشکیلدهنده استخوان هستند. از سوی دیگر، استئوکلاستها (Osteoclasts) سلولهای استخوانی قدیمی یا آسیبدیده را حل و تجزیه (جذب) میکنند و فضایی را برای استئوبلاستها فراهم میکنند تا بافت جدیدی را در مناطقی که در حال رشد یا نیاز به ترمیم هستند، ایجاد کنند. پوکی استخوان ناشی از عدم تعادل بین تشکیل استخوان و جذب استخوان است.
به نقل از نیو اطلس، یک مطالعه جدید به رهبری دانشگاه لایپزیگ در آلمان، یک تنظیمکننده حیاتی تشکیل استخوان موسوم به «گیرنده متصل به پروتئین ۱۳۳» (GPR۱۳۳) و راهی برای تحریک آن را شناسایی کرده است که پنجرهای را به روی یک استراتژی جدید برای درمان یا پیشگیری از پوکی استخوان باز میکند.
همانطور که انتظار میرود، رشد استخوان در دوران کودکی و نوجوانی بیشترین سرعت را دارد. سپس تا اواخر دهه بیست زندگی، زمانی که معمولاً به اوج توده استخوانی میرسیم، کند میشود. پس از این، تراکم استخوان برای مدتی به حالت ثابت میرسد، قبل از اینکه عموماً پس از ۵۰ سالگی، تجزیه استخوان از تشکیل استخوان پیشی بگیرد و به تدریج با افزایش سن، تراکم استخوان کاهش یابد.
گیرندههای متصل به پروتئین (GPCRs) که در سطوح سلولی یافت میشوند، میتوانند به عنوان سوئیچهای مولکولی در نظر گرفته شوند. هنگامی که یک مولکول سیگنال دهنده به GPRC متصل میشود، یک پروتئین G فعال میشود که به نوبه خود، تولید هر تعداد مولکول پیامرسان ثانویه را آغاز میکند. فعال شدن یک پروتئین G واحد میتواند بر تولید صدها یا حتی هزاران پیامرسان ثانویه و همچنین بر فرآیندهای مختلف سلولی و عملکردهای فیزیولوژیکی تأثیر بگذارد.
تحقیقات قبلی، «GPR۱۳۳» را به عنوان یک محرک ژنتیکی بالقوه برای تراکم مواد معدنی استخوان (BMD) در انسان شناسایی کرده است.
«تراکم مواد معدنی استخوان» اندازهگیری مقدار مواد معدنی، در درجه اول کلسیم و فسفر در حجم مشخصی از استخوان است و یک شاخص کلیدی برای سلامت استخوان است و BMD پایین میتواند خطر شکستگی را به ویژه در شرایطی مانند پوکی استخوان افزایش دهد.
نقش دقیق GPR۱۳۳ در هموستاز استخوان کاملاً مشخص نیست، بنابراین محققان از دستکاری ژنتیکی، سنجشهای مولکولی، تحریک مکانیکی و درمان دارویی برای بررسی مکانیسمهای مولکولی زیربنایی تأثیر GPR۱۳۳ بر تراکم مواد معدنی استخوان استفاده کردند.
موشهای فاقد ژن GPR۱۳۳ با حذف ژن GPR۱۳۳ در سراسر بدن یا به طور خاص در سلولهای پیشساز که به استئوبلاستها تمایز مییابند، ایجاد شدند. این موشها استخوانهای نازکتر، تراکم مواد معدنی استخوان پایینتر و افزایش جذب استخوان را ایجاد کردند که پوکی استخوان را شبیهسازی میکند.
مطالعات با استفاده از سلولهای بنیادی مشتق از مغز استخوان موش و سلولهای پیشساز استئوبلاست نشان داد که خاموش کردن GPR۱۳۳ به این معنی است که استئوبلاستها به درستی کار نمیکنند و نمیتوانند بالغ شوند یا استخوان بسازند، اما وقتی ژن فعال شد، سلولها نشانگرهای تمایز بیشتری تولید کردند، پروتئینهایی که به ما میگویند سلول در حال بلوغ به یک استئوبلاست کاملاً کارآمد است.
محققان با بررسی مسیرهای سیگنال دهنده دریافتند که GPR۱۳۳ از طریق مسیرهایی (آدنوزین مونوفسفات حلقوی (cAMP) و β-کاتنین) که برای رشد، بازسازی و حفظ استخوان بسیار مهم هستند، سیگنال میدهد.
آنها همچنین مشاهده کردند که فعال شدن GPR۱۳۳ حساس به مکانیسم است، به این معنی که به فشار فیزیکی شبیهسازی شده در آزمایشهای آزمایشگاهی، مانند کشش یا بارگیری پاسخ میدهد و با یک پروتئین سطح سلولی به نام PTK۷ که پیامها را بین سلولهای همسایه منتقل میکند، تعامل دارد.
هنگامی که PTK۷ به GPR۱۳۳ متصل میشود، به فعال شدن آن کمک میکند. PTK۷ و نیروی مکانیکی با هم اثر همافزایی دارند و سیگنالی را تقویت میکنند که به استئوبلاستها کمک میکند تا بالغ شوند و به درستی کار کنند.
در نهایت، محققان یک داروی مولکول کوچک به نام AP۵۰۳ را آزمایش کردند که به طور انتخابی GPR۱۳۳ را فعال میکند. موشهای سالم و موشهایی با BMD پایین که روزانه AP۵۰۳ به آنها تزریق میشد، تراکم و قدرت استخوان بیشتری داشتند. این تزریقها، تحلیل استخوان را در یک مدل موش که پوکی استخوان پس از یائسگی را تقلید میکرد، معکوس کرد. همچنین ترکیب AP۵۰۳ با ورزش منجر به یک اثر همافزایی شد و تشکیل استخوان را بیشتر تقویت کرد.
پروفسور اینس لیبشر (Ines Liebscher)، نویسنده ارشد این مطالعه از موسسه بیوشیمی رودولف شونهایمر دانشگاه لایپزیگ میگوید: اگر این گیرنده به دلیل تغییرات ژنتیکی مختل شود، موشها علائمی از کاهش تراکم استخوان را در سنین پایین نشان میدهند که مشابه با پوکی استخوان در انسان است. با استفاده از ماده AP۵۰۳ که اخیراً به عنوان محرک GPR۱۳۳ شناسایی شده است، ما توانستیم قدرت استخوان را در موشهای سالم و مبتلا به پوکی استخوان به طور قابل توجهی افزایش دهیم.
یک مطالعه قبلی به رهبری لیبشر، با همکاری دانشگاه شاندونگ در چین پیش از این نشان داده بود که فعال کردن GPR۱۳۳ با استفاده از AP۵۰۳، عضلات اسکلتی را تقویت میکند.
دکتر جولیان لمان (Juliane Lehmann)، نویسنده ارشد این مقاله از موسسه بیوشیمی لایپزیگ میگوید: تقویت موازی استخوان که به تازگی نشان داده شده است، بار دیگر پتانسیل بالای این گیرنده را برای کاربردهای پزشکی در جمعیت سالمند برجسته میکند.
استفاده از مدلهای موش به تنهایی، محدودیت مطالعه حاضر است. اگرچه اطلاعات مفیدی ارائه میدهد، اما موشها از نظر فیزیولوژی استخوان با انسان متفاوت هستند؛ بنابراین انتقال به محیطهای بالینی نیاز به احتیاط دارد.
علاوه بر این، اگرچه AP۵۰۳ از نظر اختصاصی بودن غربالگری شد، اما ایمنی طولانی مدت، اثرات بالقوه خارج از هدف و نحوه تأثیر بدن انسان بر AP۵۰۳ پس از تجویز هنوز ناشناخته است و اثرات فعالسازی GPR۱۳۳ بر سایر بافتها یا سیستمهای بدن به طور گسترده بررسی نشده است که میتواند برای درمان سیستمیک مرتبط باشد.
با این حال، با وجود این محدودیتها، یافتههای این مطالعه برخی از کاربردهای بالقوه در دنیای واقعی را برجسته میکند. GPR۱۳۳ یک هدف درمانی امیدوارکننده است که فعالسازی آن با داروهایی مانند AP۵۰۳ میتواند کلاس جدیدی از درمانهای پوکی استخوان را ارائه دهد که به طور بالقوه عوارض جانبی کمتری نسبت به گزینههای فعلی دارد.
این یافتهها همچنین پنجرهای را به سوی پزشکی شخصیسازی شده میگشاید. برخی از افراد به طور طبیعی جهشهایی در GPR۱۳۳ دارند که ممکن است آنها را مستعد پوکی استخوان کند. غربالگری این جهشها میتواند افراد در معرض خطر را برای درمان زودهنگام یا پیشگیرانه شناسایی کند.
فراتر از درمان پوکی استخوان، GPR۱۳۳ ممکن است کاربردهای وسیعتری داشته باشد. از آنجا که در رشد عضلات نیز نقش دارد، میتواند به درمان تحلیل رفتن عضلات یا تحلیل استخوان ناشی از بیتحرکی یا حتی تحلیل استخوان در فضانوردانی که در معرض جاذبه صفر قرار دارند، کمک کند.
این مطالعه در مجله Signal Transduction and Targeted Therapy منتشر شده است.





